2.3 KiB
La química estudia la composición, estructura y propiedades de la materia, asi como los cambios que ocurren en las reacciones químicas
Composición de materiales
Mezclas
- Mezclas heterogéneas, la medición en cualquier parte es diferente
- Mezclas homogéneas, la medición en cualquier parte es igual en proporción
Substancias puras
- Compuestos, están formadas a partir de elementos puros
- Elementos, conforman el mismo elemento en su mayoría
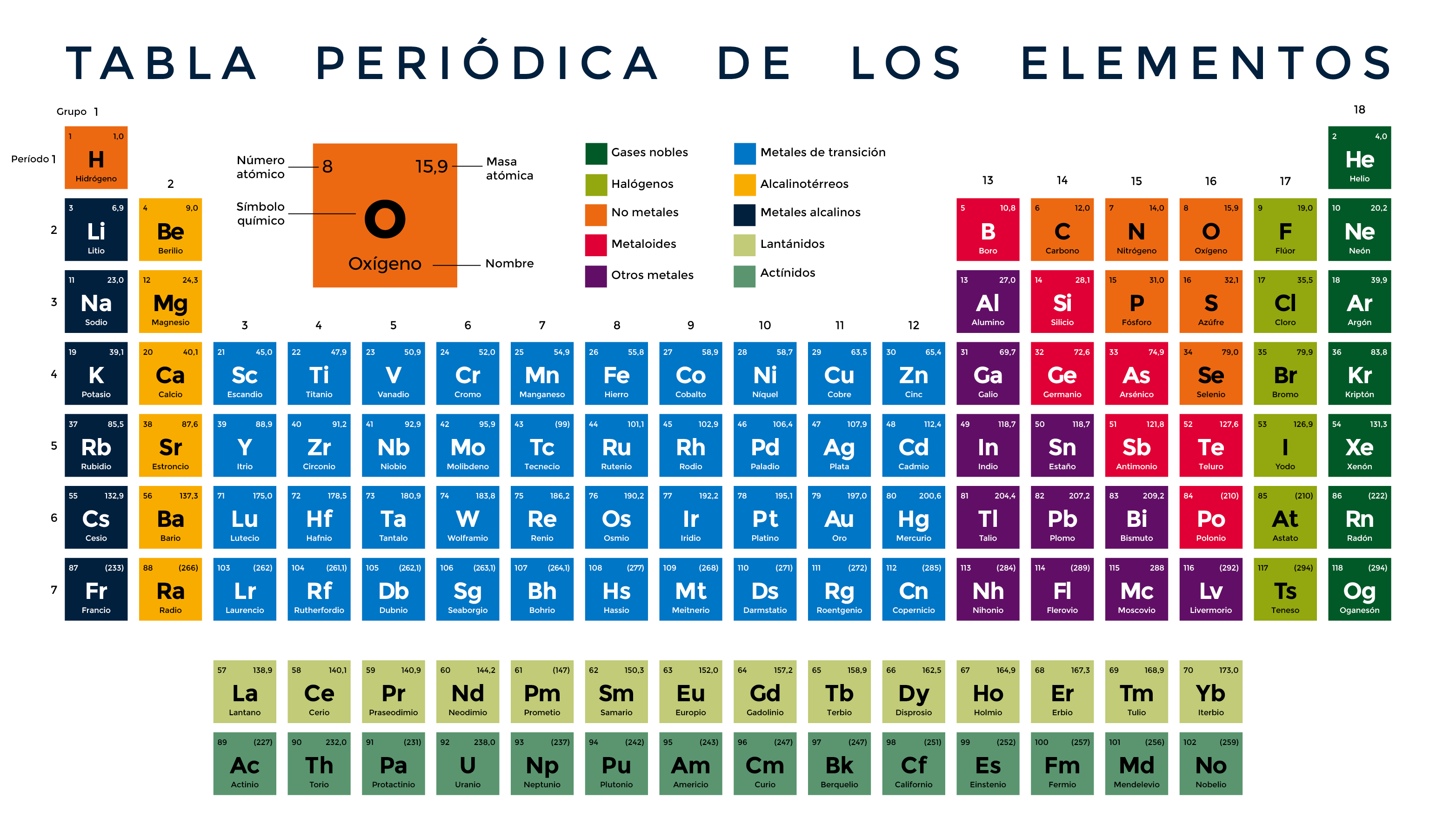
Elementos
Los elementos están formados por átomos. Los átomos están formados por protones(+), electrones(-) y neutrones (0).
- Las átomos del mismo elemento tienen el mismo número de protones.
- Mismo número de electrones (igual que el numero de protones).
- Pueden tener diferentes números de neutrones (isótopos).
Mol
Un Mol es la unidad del S.I. para la magnitud de cantidad de sustaincia.
[!NOTE] Mol Un mol equivale a 6.023* 10²³
Gases
- La forma es que se suele expresar un gas es mediante su volumen. Las unidades suelen ser: mL=cm³(10⁻³L), L o m³(10³L)
- Los gases cambian de tamaño en función de su temperatura.
Ecuación de los gases
\huge P*V=n*R*T
- Donde P es la pressión.
- V es el volumen que ocupa
- n numero de mols
- T temperatura
- R es una constante R puede ser:
[!NOTE] Importante Cuando se habla de condiciones normales nos referimos a las siguientes condiciones:
- Temperatura = 0C = 273.15K
- P= 1 atm En condiciones normales, 1 mol de cualquier gas ocupa 22.4L.
Ecuación de los gases con masa molar
\huge P*V=n*R*T=\frac mM*R*T
\quad \Rightarrow \quad
P=\frac m V * \frac {R*T} M=d*\frac {R*T} M
Si tenemos una mezcla de gases ideales podemos definir la presión parcial del gas(P$_i$), como la presión de cada gas si estuviera solo en las mismas condiciones de V y T:
\huge P_i=n_i\cdot\frac{R \cdot T} V
Debe considerarse que la suma de las presiones parciales de todos los componentes de la mezcla es la presión total:
\huge P_{total} = \sum_i P_i
Con la ecuación superior podemos encontrar la relación entre la presión parcial de un gas en una mezcla y su fracción molar(x$_i$)
\huge P_i=x_i\cdot P_{total}
\quad
x_i=\frac {n_i} {n_{total}}